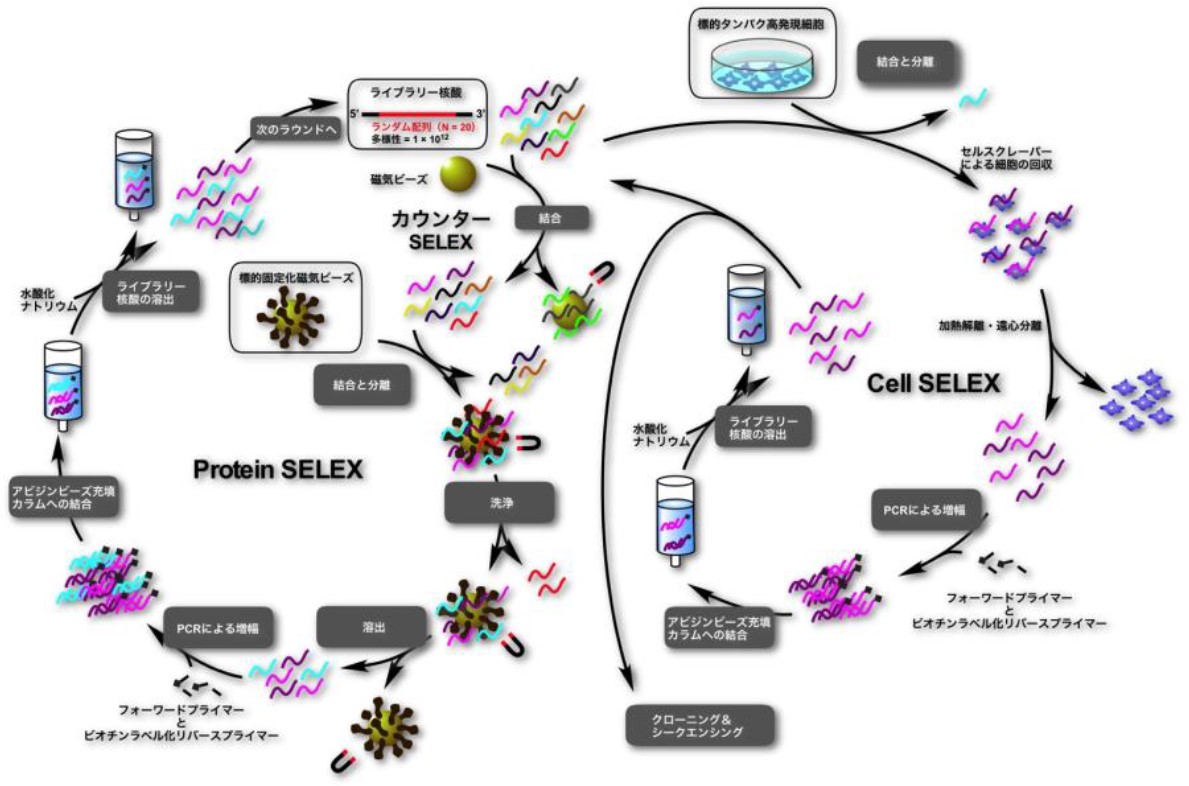
核酸アプタマーは、免疫原性が低く、化学合成が可能であることから、抗体に代わる次世代の分子認識素子、分子標的薬として着目されている。これらはSELEX (Systematic Evolution of Ligands by EXponential enrichiment) 法と呼ばれるスクリーニング法により1012以上の配列多様性を有するオリゴ核酸プール(ライブラリー)から取得される。Cell-SELEX法(細胞を対象にスクリーニングを行う手法)では、天然の構造状態と周囲環境にある膜タンパク質をそのまま標的とするため、取得されたアプタマーは当然、複雑環境下にある細胞膜上の標的に対しても高い親和性で結合可能である。しかしながら、この手法では多くのライブラリー核酸が細胞表面に非特異的に結合してしまうため、アプタマーの取得に失敗するリスクが高く、取得できた場合であっても取得に要するセレクションのラウンド数が多くなる傾向にある。一方、標的タンパク質の細胞外ドメインのみを個相担体に固定化し、セレクションを行えば、より少ないラウンド数でアプタマーを取得することが可能である。しかしながら、取得されたアプタマーは細胞上の標的を認識できるとは限らない。そこで我々は、この両手法を組み合わせる(クロスオーバーSELEX法)ことにより、細胞膜上の標的に高選択的かつ強固に結合するアプタマーの効率的な取得を試みている。
細胞表層のマーカー分子は、細胞のいわゆる指紋とも言え、細胞を識別する際の対象として非常に優れている。近年の研究により、様々な膜タンパクががん細胞マーカーとして認知されるようになってきており、これらと特異的かつ強固に結合可能な素子は、がん細胞検出ツールに応用可能である。
また、核酸アプタマーは抗体にはない興味深い特性を有している。抗体は細胞膜を透過することが難しいが、分子量が小さい核酸アプタマーは膜タンパクに結合すると、カベオラ介在性エンドサイトーシス経路で取り込まれることがわかってきている。これらの性質をあわせて利用すれば、標的とする細胞の中に、選択的に薬剤を導入する技術にも応用かのうである。